 |
| Magnitudes y unidades básicas |
Estas son algunas de las magnitudes y unidades derivadas del Sistema Internacional.
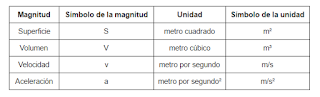 |
| Magnitudes y unidades derivadas |
Según su composición la materia se puede clasificar en: sustancias puras, que están formadas por un solo componente y sus propiedades son constantes, y en mezclas, que están constituidas por varias sustancias puras y sus propiedades varían su composición.
 |
| Sustancia pura |
 |
| Mezcla |
Los tipos de sustancias puras son: sustancias simples o elementos, que son sustancias puras formadas por uno o varios átomos de un mismo elemento químico como el hierro y el bromo, y compuestos químicos o compuestos, que son sustancias puras formadas por átomos de dos o más elementos químicos diferentes como el agua pura y el gas metano.
Los tipos de mezclas son: mezclas homogéneas, que son aquellas que a simple vista no se distinguen sus componentes como el agua embotellada y los refrescos, y mezclas heterogéneas, que son aquellas que a simple vista se distinguen sus componentes como los helados y el agua con aceite.
Los cambios físicos son aquellos en los que, cuando se producen, no se altera la composición de las sustancias que intervienen como cuando se disuelve azúcar en agua o cuando se funde el hielo.
Los cambios químicos son aquellos en los que, cuando se producen, cambia la composición de las sustancias iniciales como cuando un hierro se oxida o cuando se fabrica pan.
Los estados de agregación de la materia son: sólido, líquido, gaseoso y plasmático.
El cambio de sólido a líquido es la fusión y se aporta calor.
El cambio de líquido a gaseoso es la vaporización y se aporta calor.
El cambio de sólido a gaseoso es la sublimación y se aporta calor.
El cambio de líquido a sólido es la solidificación y y no se aporta calor.
El cambio de gaseoso a líquido es la licuación y no se aporta calor.
El cambio de gaseoso a sólido es la sublimación regresiva y no se aporta calor.
La presión puede producir efectos, una disminución de presión favorece la fusión, la vaporización y la sublimación y un aumento de presión favorece la solidificación, la condensación y la sublimación inversa. Para que se produzca un cambio de estado tiene que haber un cambio en la temperatura de un cuerpo.
Las expresiones de la concentración de una disolución son:
Los tipos de mezclas son: mezclas homogéneas, que son aquellas que a simple vista no se distinguen sus componentes como el agua embotellada y los refrescos, y mezclas heterogéneas, que son aquellas que a simple vista se distinguen sus componentes como los helados y el agua con aceite.
Los cambios físicos son aquellos en los que, cuando se producen, no se altera la composición de las sustancias que intervienen como cuando se disuelve azúcar en agua o cuando se funde el hielo.
 |
| Cambio físico |
Los cambios químicos son aquellos en los que, cuando se producen, cambia la composición de las sustancias iniciales como cuando un hierro se oxida o cuando se fabrica pan.
 |
| Cambio químico |
Los estados de agregación de la materia son: sólido, líquido, gaseoso y plasmático.
El cambio de sólido a líquido es la fusión y se aporta calor.
El cambio de líquido a gaseoso es la vaporización y se aporta calor.
El cambio de sólido a gaseoso es la sublimación y se aporta calor.
El cambio de líquido a sólido es la solidificación y y no se aporta calor.
El cambio de gaseoso a líquido es la licuación y no se aporta calor.
El cambio de gaseoso a sólido es la sublimación regresiva y no se aporta calor.
La presión puede producir efectos, una disminución de presión favorece la fusión, la vaporización y la sublimación y un aumento de presión favorece la solidificación, la condensación y la sublimación inversa. Para que se produzca un cambio de estado tiene que haber un cambio en la temperatura de un cuerpo.
 |
| Estados de agregación de la materia |
Las expresiones de la concentración de una disolución son:
Concentración = cantidad de soluto
Cantidad de solución
|
% masa – masa = masa de soluto x 100
Masa de solución
|
% volumen – volumen = volumen de soluto x 100
Volumen de solución
% masa – volumen = masa de soluto x 100
Volumen de solución

No hay comentarios:
Publicar un comentario